分子が連結して氷の結晶成長を食い止める不凍タンパク質を発見:医療技術ニュース
産業技術総合研究所は、濃度に応じて分子同士が連結し、氷の結晶成長を止める不凍タンパク質「BpAFP」を魚類から発見した。食品や細胞の中に氷の塊を作らせない凍結保存技術の開発が期待される。
産業技術総合研究所(産総研)は2017年2月16日、濃度に応じて分子同士が連結し、氷の結晶成長を止める新しいタイプの不凍タンパク質「BpAFP」を魚類から発見したと発表した。産総研生物プロセス研究部門兼産総研・東大先端オペランド計測技術オープンイノベーションラボラトリの津田栄上級主任研究員らが、ニチレイ技術戦略企画部の小泉雄史グループリーダーらと共同で行ったもので、同月13日に英科学誌「Scientific Reports」電子版に掲載された。
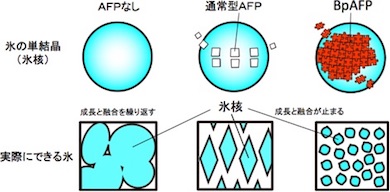
同研究ではまず、蛍光物質を付けたBpAFP水溶液の中に、球状にした氷の単結晶(φ=2cm)を入れて取り出し、蛍光を観測する実験を行った。通常、タンパク質を水に溶かす際は塩や緩衝液を加えるが、BpAFPは60%(質量パーセント濃度)の高濃度で純水に溶ける。そこで濃度を変えて実験したところ、低濃度の溶液に入れた場合では、特定の箇所だけが蛍光を発光したが、濃度を高めていくと全ての氷結晶面が蛍光を発光した。不凍タンパク質(AFP)には氷核の一部に結合するタイプと全面に結合するタイプ(高機能型AFP)があるが、BpAFPは高濃度になるほど氷核への結合範囲が拡大するという、新しいタイプの高機能型AFPであることが明らかになった。
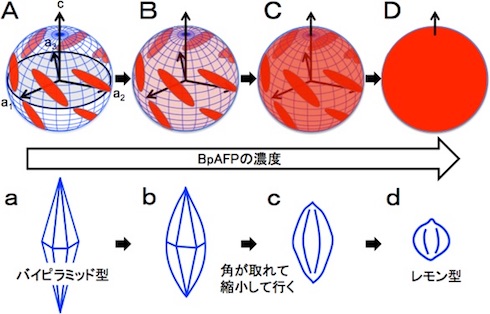
次にBpAFP水溶液を顕微鏡下で凍らせて氷核を調べた。すると、BpAFPの濃度が高くなるにつれて、先のとがった型から丸みを帯びた型に変化し、サイズも徐々に小さくなることが分かった。また、氷結晶との結合力の指標である熱ヒステリシスの最大値は3.2℃だった。これは、BpAFPが氷核の成長と融合を阻止する能力に優れることを示している。
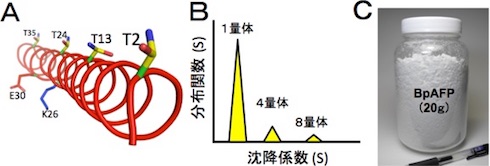
さらに、分子構造について解析したところ、BpAFPは連続したアラニンを多く含むアミノ酸配列から成る小さな分子であることが分かった。αらせん型構造を形成しており、100℃に加熱後も構造を維持し、pH3〜8の間でも失活しない。濃度に応じて4量体や8量体を形成し、氷核への結合様式を変える。これらの結果から、BpAFPは水溶性に優れ、安定性の高い分子構造を示し、連結して氷核の全表面を覆い尽くすことにより、氷核の結晶成長と融合を強く抑制すると考えられる。
このようなBpAFPを用いることで、食品や細胞の中に氷の塊を作らせない新たな凍結保存技術の開発が期待される。また、今回開発した高精製度BpAFP試料には、水の凍結や食材、細胞などに影響を及ぼす塩や緩衝液成分が含まれていないため、希少性の高い試薬や移植用細胞などに対しての応用も可能だという。
通常の氷は、無数の氷核が融合したもので、それらが時間とともに成長して塊になる。これが冷凍食品の品質や凍結細胞の生命力を低下させる原因になっている。AFPは、0℃よりやや低い温度域でも氷核の成長と融合を抑制できるが、既知の高機能型AFPは昆虫などに含まれる極微量成分であり、実用可能な高機能型AFPの開発が強く望まれていた。
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
 モノづくりを変革する“軽くて強い”炭素繊維、課題の生産性を10倍に
モノづくりを変革する“軽くて強い”炭素繊維、課題の生産性を10倍に
NEDOは東京大学、産業技術総合研究所、東レ、帝人(東邦テナックス)、三菱レイヨンとともに、従来の製造プロセスに比べて、製造エネルギーとCO2排出量を半減し、生産性を10倍に向上できる新たな炭素繊維製造プロセスの基盤技術を確立したと発表した。炭素繊維の大量生産や低コスト化を実現するという。 203X年のトラックは自動運転が主流に!? 「世界トップレベル」の技術に迫る
203X年のトラックは自動運転が主流に!? 「世界トップレベル」の技術に迫る
産総研のつくば北サイトで、大型トラックの燃費向上やドライバーの運転負荷軽減などを目的とした、自動運転・隊列走行技術の実証実験が行われた。研究開発を統括するNEDOの理事長を務める古川一夫氏が「世界トップレベル」と自負するその技術をリポートする。 アーキテクトモデルの実現とアルパインの取り組み
アーキテクトモデルの実現とアルパインの取り組み
技術ばらしプロセスで検討フェイズ作業を27%削減! これからの製品開発に求められるアーキテクト力とブレない設計・開発のための秘策とは 災害救助ロボットコンテスト、入賞チームが語るロボット開発の詳細
災害救助ロボットコンテスト、入賞チームが語るロボット開発の詳細
災害救助ロボットコンテスト「DARPA Robotics Challenge」で優勝した、韓国「TEAM KAIST」のロボットは何がスゴかったのか。競技の詳細をお伝えするとともに、大会後に開催されたワークショップで語られた、上位入賞チームによる開発の詳細をお伝えする。 「米国ベンチャーに負けない!!」――NEDO、生活支援ロボット実用化プロジェクトの成果を報告
「米国ベンチャーに負けない!!」――NEDO、生活支援ロボット実用化プロジェクトの成果を報告
新エネルギー・産業技術総合開発機構(NEDO)は、5年にわたり実施してきた「生活支援ロボット実用化プロジェクト」に関する成果報告会を実施。同プロジェクトに参画した2社のロボットが、世界で初めて国際安全規格「ISO 13482」の認証を取得した。