海外で進む医療ソフトウェア臨床評価の標準化:海外医療技術トレンド(20)(2/2 ページ)
日本では、2014年11月の医薬品・医療機器等法施行により、スタンドアロン製品として承認申請や市販後対策の対象となった医療ソフトウェア。海外では、国境を越えた国際標準化への取り組みが着々と進んでいる。
医療ソフトウェアの臨床評価は日本のレギュラトリーサイエンスの課題
今回FDAが公開したガイドライン草案では、前述の定義、分類を前提として、SaMDの臨床エビデンスを作るために利用できる適切な評価手法とプロセス、異なるカテゴリーのSaMDに必要な臨床エビデンスのレベル、独立したレビューが重要なカテゴリーおよび重要でないカテゴリーを記述することによって、臨床評価の指針を提供することを目的としている。
SaMDの臨床評価には、以下のような科学的妥当性、分析的妥当性、臨床性能に関するエビデンスを収集・評価する作業が含まれるとしている。
- 科学的妥当性:臨床SaMDの病態へのアウトプットのつながりを実証する
- 分析的妥当性:生活性に関する技術的性能を実証する
- 臨床性能:健康状態におけるSaMDのアウトプットの用途に関連する/臨床的に意味のあるアウトプットを生成するために必要なSaMDの機能を検証する
また、SaMDの臨床評価のエビデンスについては、信頼性の観点から、独立したレビューが求められるケースが想定される。今回の草案では、どのような場合にレビューが必要となるかについて、図2のような形で提示している。
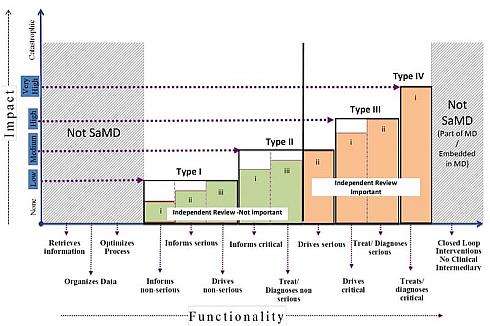
図2 SaMDの臨床評価と独立したレビューの重要性の関係(クリックで拡大) 出典:FDA「Draft Guidance: Software as a Medical Device (SaMD): Clinical Evaluation」(2016年10月14日)
どの分類に該当するかの判断については、個別のSaMDの意図とする目的や対象領域に依存するところも多いので、治験・臨床試験実施計画書の策定時に綿密な検討を行っておく必要がある。
なお今回の草案の策定に当たっては、以下のドキュメントを参照している。
- SaMD N10 ソフトウェア・アズ・ア・メディカル・デバイス(SaMD):主要な定義
- SaMD N12 ソフトウェア・アズ・ア・メディカル・デバイス(SaMD):リスク分類と対応の考慮事項のための可能なフレームワーク
- SaMD N23 ソフトウェア・アズ・ア・メディカル・デバイス(SaMD):品質管理システムの適用
- GHTF SG5 /N6 IVD医療機器の臨床エビデンス - 主要な定義と概念
- GHTF SG5 /N7 IVD医療機器の臨床エビデンス - 科学的妥当性の決定と性能評価
- GHTF SG5 /N8 IVD医療機器の臨床エビデンス - 体外診断用医療機器の臨床評価研究
- GHTF SG5 /N3 臨床試験
- GHTF SG5 /N2 臨床評価
- GHTF SG5 /N1 臨床エビデンス - 主要な定義と概念
- GHTF SG5 /N4 市販後臨床フォローアップ研究
- GHTF SG1 /N68 医療機器の安全性と性能の基本要件
- ISO 14155-1:2011 人体向け医療機器の臨床試験-グッドクリニカルプラクティス
- ISO 14971:2007リスクマネジメントの医療機器への適用
- IEC 80002-1:2009医療機器ソフトウェア−第1部:医療機器ソフトウェアへのISO 14971の適用の手引
参考までに、FDAは「医療機器」としての承認、監視対象となる医療ソフトウェアに関連して、以下のようなガイドライン類を策定、公開している。
| 施行時期 | ガイドライン名 | 内容 |
|---|---|---|
| 2005年1月 | Guidance for Industry - Cybersecurity for Networked Medical Devices Containing Off-the-Shelf (OTS) Software(関連情報、PDFファイル) | ネットワークに接続される 市販品(OTS)ソフトウェアを組み込んだ医療機器のサイバーセキュリティ対策指針(ソフトウェアパッチなどの手段によるサイバーセキュリティ対策のための修正については医療機器の設計変更とはならない点を明記) |
| 2005年5月 | Guidance for Industry and FDA Staff - Guidance for the Content of Premarket Submissions for Software Contained in Medical Devices(関連情報、PDFファイル) | 医療機器に含まれるソフトウェア(スタンドアロンソフトウェアを含む)の承認申請手続内容に関する指針 |
| 2013年9月 | Mobile Medical Applications -Guidance for Industry and Food and Drug Administration Staff | 医療機器としてのモバイル医療アプリケーションの対象範囲や規制要件に関する指針 |
| 2014年10月 | Content of Premarket Submissions for Management of Cybersecurity in Medical Devices - Guidance for Industry and Food and Drug Administration Staff(関連情報、PDFファイル) | 医療機器のサイバーセキュリティ管理に係る承認申請手続の内容に関する指針 |
| 2015年2月 | Medical Device Data Systems, Medical Image Storage Devices, and Medical Image Communications Devices - Guidance for Industry and Food and Drug Administration Staff(関連情報、PDFファイル) | 低リスクで規制の適用外となる医療機器データシステム(MDDS)、医用画像保管装置、医用画像通信装置を示した指針 |
| 2015年2月 | Mobile Medical Applications - Guidance for Industry and Food and Drug Administration Staff(関連情報、PDFファイル) | 前述の医療機器データシステム(MDDS)、医用画像保管装置、医用画像通信装置向けガイドラインを、医療機器としてのモバイル医療アプリケーションに反映させた改正指針 |
| 表2 米国FDAの医療ソフトウェアに関連する主要なガイドライン類 出典:FDA公開資料を基にヘルスケアクラウド研究会作成(2016年11月) | ||
加えて、「非医療機器」のソフトウェアを所管するFTCも、2016年4月6日、保健福祉省(HHS)傘下の国家医療IT調整室(ONC)、公民権局(OCR)、食品医薬品局(FDA)と共同で、モバイルヘルスアプリケーション開発者向けのガイドラインを公表している(本連載第13回)。
米国と比較して、スタンドアロンの医療ソフトウェアを対象とした法規制の歴史が浅い日本は、規制当局や国内第三者認証機関の経験、ノウハウが十分に蓄積されておらず、臨床評価に関わる人材の育成も途上段階にあるので、臨床評価手法などレギュラトリーサイエンスの取組が追い付かないのが実情だ。
スタンドアロンの医療ソフトウェア開発に従事する企業やエンジニアにとっては、これら海外との差分を埋める規制対応が高いハードルとなる可能性があるので、海外の最新動向に注意を払う必要がある。
筆者プロフィール
笹原英司(ささはら えいじ)(NPO法人ヘルスケアクラウド研究会・理事)
宮崎県出身。千葉大学大学院医学薬学府博士課程修了(医薬学博士)。デジタルマーケティング全般(B2B/B2C)および健康医療/介護福祉/ライフサイエンス業界のガバナンス/リスク/コンプライアンス関連調査研究/コンサルティング実績を有し、クラウドセキュリティアライアンス、在日米国商工会議所等でビッグデータのセキュリティに関する啓発活動を行っている。
Twitter:https://twitter.com/esasahara
LinkedIn:https://www.linkedin.com/in/esasahara
Facebook:https://www.facebook.com/esasahara
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
- 連載「海外医療技術トレンド」バックナンバー
 米国の事例に見る、マルチデバイス化する「非医療機器」のリスク管理
米国の事例に見る、マルチデバイス化する「非医療機器」のリスク管理
近年、健康増進用途の消費者向けウェアラブル端末やモバイルソフトウェアなど、医薬品医療機器等法(薬機法)の適用対象外となる「非医療機器」のマルチデバイス化が進んでいる。それに伴ってどのようなリスクが出てくるのか。米国の動向をみてみよう。 米国が推進するリスクベースのモバイルヘルスアプリ開発
米国が推進するリスクベースのモバイルヘルスアプリ開発
世界各国でモバイルヘルスアプリケーションの開発に向けた競争が激化する中、規制当局が要求する品質/安全管理対策の水準も確実に上がっている。開発者はどのような点に注意したらよいのだろうか。 ヘルスソフトウェアの業界ガイドラインを制定する協議会が発足へ
ヘルスソフトウェアの業界ガイドラインを制定する協議会が発足へ
電子情報技術産業協会(JEITA)は2014年4月11日、保健医療福祉情報システム工業会(JAHIS)、日本画像医療システム工業(JIRA)と共同で、法規制対象外の医療用ソフトウェアに関するガイドラインの策定など目指してヘルスソフトウェア推進協議会(仮称)の設立する方向で検討を開始したと発表した。 医薬品医療機器等法(薬機法)の全体像を俯瞰する
医薬品医療機器等法(薬機法)の全体像を俯瞰する
2014年11月に施行された医薬品医療機器等法は、従来の薬事法と比べて医療機器の開発に関わる部分で大きな改正が行われた。本連載では「薬機法」の略称で呼ばれている同法について医療機器開発の観点から解説していく。第1回では、改正前の薬事法との比較から薬機法の全体像を俯瞰する。