医療機器関連でも域内統一化に向けたルール改正が集中するEU市場:海外医療技術トレンド(17)(3/3 ページ)
2016年6月23日(欧州時間)に実施された国民投票で欧州連合(EU)離脱を選択した英国とは裏腹に、EU全体の医療機器関連市場では、域内ルールの統一化に向けた準備作業が同時並行で進んでいる。
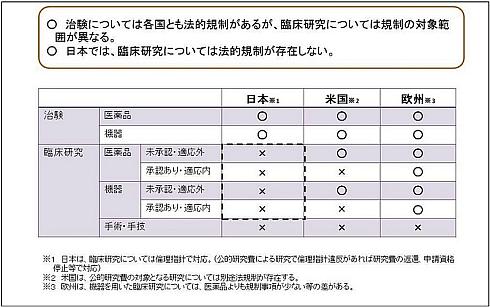
日本と欧州の規制の仕組みの違いを再確認しよう
表1は、厚生労働省の「臨床研究に係る制度の在り方に関する報告書」(2014年12月11日)より、日本と欧米の臨床試験制度の現状を比較したものだ(関連情報、PDFファイル)。
日本では、治験と臨床研究を区別し、前者には「医薬品医療機器等法」、後者には「人を対象とする医学系研究に関する倫理指針」(関連情報)が適用される仕組みになっているのに対し、欧米では、治験であるか否かに関わらず、臨床研究/臨床試験を一律規制している。半面、治験/臨床研究/臨床試験に関するルールについては、医薬品と医療機器の区別なく適用されるのが、日本の通例だ。
日本でも、医薬品と医療機器を組み合わせた、新しいタイプの医療製品開発をめざす企業が増えている。臨床開発の段階で規制対応を誤ると、大きな時間のロスとなりかねないが、日米欧間のギャップを逆手にとってうまく生かせれば、製品戦略を加速させることもできる。今後、日本の医療機器業界では歴史の浅いメディカルアフェアーズ部門が果たすべき役割も大きい。
筆者プロフィール
笹原英司(ささはら えいじ)(NPO法人ヘルスケアクラウド研究会・理事)
宮崎県出身。千葉大学大学院医学薬学府博士課程修了(医薬学博士)。デジタルマーケティング全般(B2B/B2C)および健康医療/介護福祉/ライフサイエンス業界のガバナンス/リスク/コンプライアンス関連調査研究/コンサルティング実績を有し、クラウドセキュリティアライアンス、在日米国商工会議所等でビッグデータのセキュリティに関する啓発活動を行っている。
Twitter:https://twitter.com/esasahara
LinkedIn:https://www.linkedin.com/in/esasahara
Facebook:https://www.facebook.com/esasahara
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
- 連載「海外医療技術トレンド」バックナンバー
 米国FDAが強化を求める医療機器のサイバーセキュリティ
米国FDAが強化を求める医療機器のサイバーセキュリティ
重要情報インフラの中でも、サイバー攻撃による脅威の拡大が顕在化している米国の医療界。医療のICTサプライチェーンを担う医療機器企業に対するセキュリティの要求事項も高度化している。 医療ビッグデータの利活用で世界をリードするデンマーク
医療ビッグデータの利活用で世界をリードするデンマーク
国民共通番号制度とナショナルデータベースで、日本の先を行くデンマーク。医療ビッグデータ利活用のための仕組みづくりも進んでいる。 欧州連合のeヘルス戦略は社会課題解決のパッケージ輸出を狙う
欧州連合のeヘルス戦略は社会課題解決のパッケージ輸出を狙う
ベビーブーマーの高齢化に挑む米国の「ヘルスIT」。これに対して、医療・介護福祉分野の課題解決先進国が顔をそろえる欧州連合(EU)が推進するのが「eヘルス」だ。