バイオ医薬品の開発を加速するExD セル、見えなかった解離パターンを可視化:素材/化学インタビュー(1/2 ページ)
バイオ医薬品は副作用が少なく疾患領域が広いことで期待を集めている。このバイオ医薬品の研究開発に役立つ液体クロマトグラフ飛行時間型質量分析計用の小型装置を手掛けるアジレント・テクノロジーの芹野武氏に話を聞いた。
アジレント・テクノロジーは2024年6月19日、液体クロマトグラフ飛行時間型質量分析計「6545XT AdvanceBio LC/Q-TOF」用の小型装置「Agilent ExD セル」を製品化したと発表した。
同社 市場開発部門 市場開発部 質量分析計(MS)担当 マーケティングマネージャー 工学博士の芹野武氏に、6545XT AdvanceBio LC/Q-TOFの開発背景と概要、Agilent ExD セルの特徴、専用のソフトウェア、販売の経緯などについて聞いた。
より多くの解離パターンを検出できるAgilent ExD セル
MONOist 6545XT AdvanceBio LC/Q-TOFの開発背景と概要を教えてください。
芹野氏 近年、バイオテクノロジーを利用して創薬されるバイオ医薬品の市場が急速に成長している。バイオ医薬品の開発では、これを構成するモノクローナル抗体(mAb)や抗体薬物複合体、ペプチド、オリゴ(糖鎖)などの分析が必要となる。
これらの分析プロセスは、対象のサンプルを分析可能な状態に前処理した後、サンプルから必要な部分をクロマトグラフィーで化合物ごとに分離し、質量分析計で検出/分析して、得られた分析データを解析することで構造などを解明し、レポート化する。
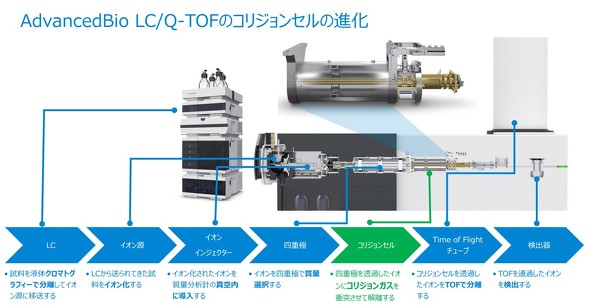
6545XT AdvanceBio LC/Q-TOFは検出/分析で利用する装置で、液体クロマトグラフ(LC)、イオン源、イオンインジェクター、MS、四重極、コリジョンセル、Time of Flight(TOF)チューブ、検出器などから成る。
同装置の作業手順は、まずLCでサンプルの化合物を分離してイオン源に移送した後、イオン化する。次に、イオンインジェクターでイオン源内のイオンをMSの真空内に導入。続いて、このイオンを四重極で質量選択し特定の質量のイオンを通過させる。四重極を透過したイオンは、コリジョンセル内におけるコリジョンガスの衝突によって解離され、その後TOFチューブ内で分離/透過したイオンの分子量を検出器で検出する。
同装置はコリジョンガスを用いたコリジョン誘起解離(CID)によりイオンを解離し、フラグメントイオンを生成する。具体的には、窒素ガスやヘリウムガスなどのコリジョンガスをイオンに衝突させることで、フラグメントイオンが生成される。
ペプチドやプロテインなどのアミノ酸がペプチド結合で結合された高分子では、ペプチド結合の中央で起こるb-y解離によってフラグメントイオンが主に生成される。バイオ医薬品の開発では細胞の応答を調節する仕組みの1つである翻訳後修飾(PTM)の位置を特定すること求められているが、ペプチド中に修飾可能な位置が複数ある場合に、b-y解離の情報だけでは修飾位置を決定することが困難だ。この問題を解消するのがAgilent ExD セルとなる。
MONOist Agilent ExD セルの特徴を教えてください。
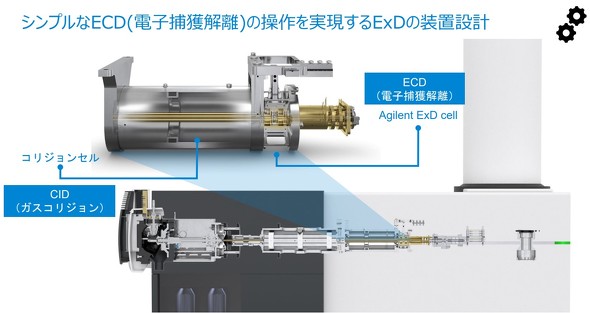
芹野氏 6545XT AdvanceBio LC/Q-TOFにAgilent ExD セルを装着することで電子捕獲解離(ECD)を行えるようになる。Agilent ExD セルによるECDは、四重極を通過したイオンにExDのフィラメントから放出された電子を作用させ、より多くの解離パターンを検出できるようにする。
具体的には、2価以上の価数のポジティブイオンを開裂させる他、ペプチド主鎖(-b、-yだけでなく、-bc、-zなども多い)を開裂させる。つまり、ECDにより、b-y解離に加えて、a-x解離、c-z解離のフラグメントイオンも生成できる。そのため、例えばPTMでは、ペプチド中の正確な修飾位置を決められ、CIDより多くの情報を得られる。加えて、ECDは開裂によってペプチド主鎖中のロイシン(Leu)/イソロイシン(Ile)、アスパラギン酸(Asp)/イソアスパラギン酸(isoAsp)などの構成しているアミノ酸の異性体も識別できる。
Copyright © ITmedia, Inc. All Rights Reserved.