「スーパー・アスピリン」開発に期待、プロスタグランジン受容体の立体構造を解明:医療技術ニュース
関西医科大学は、急性炎症の痛みや腫れ、発熱などに関与するプロスタグランジン(PG)の受容体の立体構造をX線結晶構造解析によって解明した。アスピリンより有効で、副作用の少ない「スーパー・アスピリン」の開発が期待される。
関西医科大学は2018年12月4日、急性炎症の痛みや腫れ、発熱などに関与するプロスタグランジン(PG)の受容体の立体構造をX線結晶構造解析によって解明したと発表した。同大学 教授の清水拓也氏らの研究グループと、京都大学、熊本大学が共同で研究した。アスピリンより有効で、副作用の少ない「スーパー・アスピリン」の開発につながることが期待される。
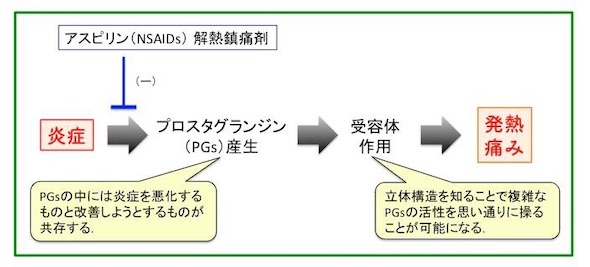
PGは、特異的な受容体に結合することで、急性炎症や慢性炎症、がんなどに深く関与することが知られている。PGの1つであるPGE2受容体は、Gたんぱく共役受容体(GPCR)と呼ばれる膜たんぱく質で、創薬の標的として知られている。このPGE2に応答する細胞は、異なるPGE2受容体(EP1〜EP4)を介して、複数の異なるシグナルを伝達する。
例えば、アスピリンなどの非ステロイド性抗炎症薬(NSAIDs)は、PG合成酵素を阻害することで、PGの生合成を抑えて効果を発揮する。近年では、PGのがんへの作用も注目され、PGE2-EP4シグナルを阻害するEP4拮抗薬は、抗がん剤として複数の製薬会社で治験が行われている。
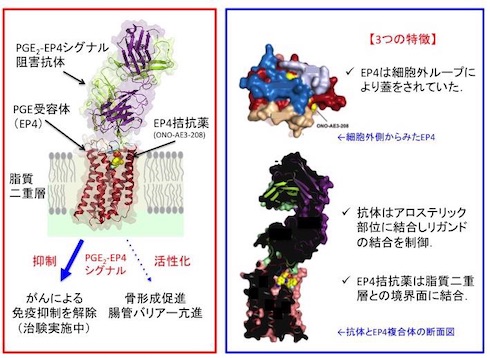
今回の研究では、EP4拮抗薬(ONO-AE3-208)が結合したEP4および抗体の複合体の立体構造と、PGE2が結合したEP3の立体構造を解明。EP3とEP4の全体構造は、GPCRと同様に7本の膜を貫通したらせん構造を持つことが分かった。また、2番目の細胞外ループがβヘアピン構造となっており、PGE2が結合する場所に蓋をするように覆っていた。そのためONO-AE3-208は、細胞の外側から直接受容体に結合するのではなく、細胞膜の中に入ってから脂質二重層との境界面に結合することが示唆された。
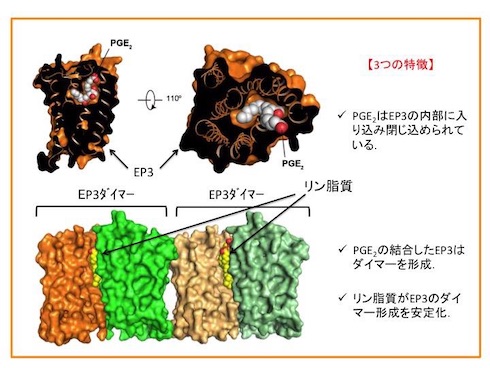
PGE2は、ONO-AE3-208よりも受容体の奥に入り込み、完全に閉じ込められていた。EP3は、ダイマーを形成し、脂質二重層の成分であるリン脂質がダイマーを安定化していることが示唆された。これは、新しい薬剤の設計につながる重要な構造情報だという。
さらに、PGE2-EP4シグナルを阻害する抗体は、EP4の細胞外領域に結合し、PGE2の結合を阻害していることが分かった。これは、脂質受容体をターゲットにした抗体医薬の開発につながると考えられる。
PGE2とEP3、EP4拮抗薬とEP4の結合様式が判明したことで、これらの立体構造をベースに、複雑なPGの作用をある程度狙い通りに操作できる可能性がある。これにより、慢性炎症、がん、精神疾患などに対して、有効性が高く、副作用の少ない治療薬の探索・設計が期待される。
Copyright © ITmedia, Inc. All Rights Reserved.
関連記事
 3種類のタンパク質で構成、活性酸素を除去するマイクロマシンを開発
3種類のタンパク質で構成、活性酸素を除去するマイクロマシンを開発
産業技術総合研究所は、活性酸素を除去する「タンパク質マイクロマシン」を3種類のタンパク質だけで作製することに成功した。抗体が活性酸素を分泌する細胞を捕捉し、炎症性疾患悪化の原因となる過剰な活性酸素を除去する。 炎症を促進するタンパク質の作用を解明、自己免疫疾患などの新しい治療法へ
炎症を促進するタンパク質の作用を解明、自己免疫疾患などの新しい治療法へ
大阪大学は、炎症を促進させるRNA安定化分子「Arid5a」の炎症過程における局在制御機構を解明した。敗血症性ショックや自己免疫疾患などの新しい治療法の開発につながると期待される。 涙に含まれるコレステロール硫酸が眼を炎症細胞の浸潤から守る
涙に含まれるコレステロール硫酸が眼を炎症細胞の浸潤から守る
九州大学は、涙の中に含まれるコレステロール硫酸という脂質が、免疫細胞の動きに重要な「DOCK2」というタンパク質の機能を阻害し、眼を炎症細胞の浸潤から守る働きをしていることを発見した。 慢性炎症による大腸がん悪性化の仕組みを解明
慢性炎症による大腸がん悪性化の仕組みを解明
金沢大学は、慢性炎症による大腸がん悪性化の仕組みについて明らかにした。悪性化の過程に慢性炎症反応が関わっている可能性があり、今後、慢性炎症の制御によってがんの悪性化を制御できると期待される。 生体内多機能物質ラクトフェリンが炎症を制御するメカニズムを解明
生体内多機能物質ラクトフェリンが炎症を制御するメカニズムを解明
慶應義塾大学は、生体内多機能物質ラクトフェリンによる、新たな炎症制御メカニズムを解明した。ラクトフェリンが過剰な自然免疫反応を抑制し、炎症を制御する可能性を示した。