「Apple Watch Series 4」の心電図アプリはFDA認証をどうやって取得したのか:海外医療技術トレンド(39)(2/3 ページ)
グローバルプラットフォーマーのウェアラブル型医療機器市場参入の裏側には、規制当局からイノベーション当局へのトランスフォーメーションをめざすFDAの政策がある。
画期的医療機器とリアルワールドエビデンスの先にあるAI技術
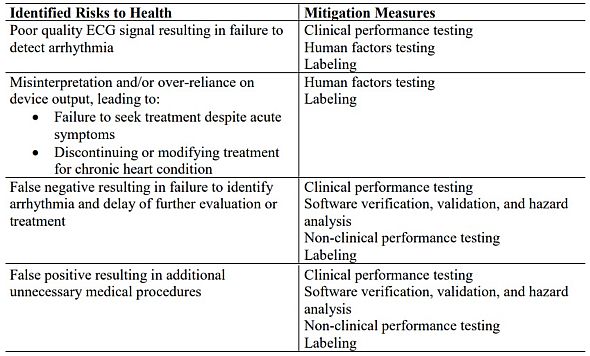
次に、表1は、前述のFDAのアップル宛通知文書より、ECGアプリケーションに関して特定された健康リスクおよび低減手段を示している。
FDAは、表1の低減手段5項目について、以下のようなOTC心電計ソフトウェア特有のコントロール策を例示している。
- 臨床パフォーマンス評価
- a.表示と分析のために十分な品質のECGを取得する能力
- b.感度と特異性または陽性的中率によって報告される検知アルゴリズムのパフォーマンス特性
- ソフトウェアの検証・バリデーション・ハザード分析:文書化には、検知アルゴリズム、インプットとアウトプットなど、ソフトウェアの技術仕様の特徴付けが含まれなければならない
- 非臨床パフォーマンス評価:過去に判断が下されたデータセットを使用して、検知アルゴリズムのパフォーマンスを検証する
- ヒューマンファクター・ユーザビリティ評価
- a.ユーザーは、デバイスの表示を読むだけで、デバイスを正しく使用することができる
- b.ユーザーは、デバイスのアウトプットを正しく翻訳し、いつ医療ケアを探すかを理解する
- 表示
- a.ハードウェアプラットフォームとOSの要求事項
- b.デバイスが、期待されたパフォーマンスレベルで操作できない可能性のある状況
- c.デバイスで実施した臨床パフォーマンス評価の概要
- d.デバイスが何を評価してどのようなアウトプットをユーザーに出すかの記述
- e.あらゆる結果の翻訳に関する指針
過去に、FDAのDe Novo申請制度を利用した医療機器の市販前申請事例としては、AI(人工知能)がある。例えば、アイオワ州の医療AIスタートアップ企業IDxは、眼底カメラの網膜画像をAIアルゴリズムを介して分析し、成人糖尿病患者の糖尿病網膜症を検知する医療ソフトウェア「IDx-DR」を画期的機器プログラムを利用して申請し、2018年4月11日に承認を受けている(関連情報)。
また、ECGアプリケーション関連のDe Novo分類申請利用事例としては、カリフォルニア州の医療AIスタートアップ企業アライブコア(AliveCor)が、2018年9月10日、ECGデータからニューラルネットワークを利用して高カリウム血症を検知する「KardiaK Software Platform」について、FDAからDe Novo申請制度の画期的機器として認められ、審査プロセスに入ったことを発表した事例がある(関連情報)。
アライブコアのCEOを務めるヴィック・グンドトラ氏は、元グーグル(Google)の上級副社長で、「Google+」の生みの親として知られている。同社は、2017年11月16日、FDAよりApple Watchと連携するウェアラブル型心電計「Kardia Band」の市販前承認を受けている(関連情報、PDF)。
なお、モバイル/ウェアラブル型心電図計から生成されるデータのリアルワールドエビデンス(RWE)化に関連して、FDAは、本連載第28回で取り上げた「医療機器の規制に関わる意思決定を支援するリアルワールドエビデンス利用 - 業界および食品医薬品局スタッフ向けガイダンス」(関連情報、PDF)の中で、「人道機器適用免除、事前承認申請(PMA)、De Novoの承認または付与をサポートするエビデンスとして」を用途の1つに挙げている。
このようにみると、今回FDAが承認したApple Watch向けECGアプリケーションの先には、生成されるリアルワールドデータ(RWD)があり、AIに代表される新技術を適用した画期的なデバイスやソフトウェアが待機していることが分かるだろう。
Copyright © ITmedia, Inc. All Rights Reserved.