3Dプリンタによる医療機器製造、米国で進む品質管理とサイバーセキュリティ対策:海外医療技術トレンド(15)(1/3 ページ)
医療機器にも応用されつつある3Dプリンタ。米国では、3Dプリンタと関わる、クオリティコントロールやサイバーセキュリティ対策に関する仕組みづくりも進んでいる。
医療機器、再生医療、バイオ医薬品で応用される3Dプリンタ技術
CADで作成した3Dデータを設計図として、樹脂や金属などを加工し、立体物を作る付加製造(AM:Additive Manufacturing)技術が「3Dプリンタ」だ。内外を問わず、さまざまなモノづくりの分野で普及しつつある(関連情報)。
医療分野では、医療機器、再生医療、バイオ医薬品などで、3Dプリンタ技術が応用されている。米国食品医薬品局(FDA)は、2015年12月時点で、85以上の3Dプリンタ製医療機器を承認している(関連情報)。日本でも、歯科用矯正機器、人工骨などの領域から、臨床応用の取組が広がりつつある
米国FDAが、3Dプリンタで製造する医療機器のガイドライン草案を公開
3Dプリンタで製造する医療機器を米国に輸出する場合、他の医療機器と同様に、FDAの品質システム規制(QSR:Quality System Regulation)に基づく要求事項を順守する必要がある。

図1 付加製造機器の技術的留意点−業界およびFDAスタッフ向けドラフトガイダンス(クリックで拡大) 出典:FDA「Technical Considerations for Additive Manufactured Devices - Draft Guidance for Industry and Food and Drug Administration Staff」(2016年5月10日)
FDAは、2014年10月8〜9日、Additive Manufacturing of Medical Devices医療機器の付加製造に関する公開ワークショップを開催し、3Dプリンタを利用して製造する医療機器の設計・製造・試験・バリデーションに関する具体的な検討を行っている(関連情報)。
その後、2016年5月10日、FDAの医療機器・放射線保健センター(CDRH)と生物製品評価研究センター(CBER)は、「付加製造機器の技術的留意点 -業界およびFDAスタッフ向けドラフトガイダンス」を公開し、パブリックコメントの募集を開始した(図1参照、関連情報、PDFファイル)。なお、今回の草案では、FDAの医薬品評価研究センター(CDER)が所管するバイオ医薬品関連3Dプリンタ技術は対象外となっている。
同草案は、大別すると、設計/製造プロセスの要求事項と機器試験の要求事項から構成されている。図2のフローチャートは、同草案がカバーする付加製造プロセスの全体像を示したものだ。最初に設計プロセスからスタートして、ソフトウェアワークフローやマテリアルコントロールのプロセスが続き、さらに3Dプリンタを利用した機器の構築、ポストプロセッシングを経て、機器試験のプロセスに至る流れとなっている。
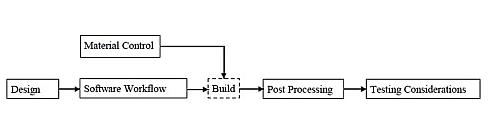
図2 付加製造プロセスのフローチャート(クリックで拡大) 出典:FDA「Technical Considerations for Additive Manufactured Devices - Draft Guidance for Industry and Food and Drug Administration Staff」(2016年5月10日)
Copyright © ITmedia, Inc. All Rights Reserved.