AI医療機器やGCP査察を巡る多国間連携と働き方改革、日本のPMDAの対応は:海外医療技術トレンド(109)(3/4 ページ)
本連載第104回で米国、カナダ、英国のAI医療機器指導原則を取り上げたが、それと並行して国境を越えた規制監督業務DXの取り組みも進んでいる。
コロナ禍で拡大した分散型臨床試験へのGCP査察の対応策は?
前述の3カ国合同ワークショプで、デジタルヘルスに続き議論されているのが、分散型臨床試験だ。FDAのプレゼンテーションでは、最初に「分散型(Decentralized)」と「ポイントオブケア/実用的」(Point of Care (POC)/Pragmatic)というキーワードを示している(関連情報)。
FDAは、分散型要素に関しては、以下のような特徴点を挙げている。
- 臨床試験活動の一部または全てが、伝統的な臨床試験サイト以外の場で起きている(例.参加者の自宅、地域医療施設)
- 柔軟性がある可能性がある - 臨床試験が起きる可能性がある場の選択肢(例:破壊的な緊急事態向けのコンティンジェンシープランの場)
- 新型コロナウイルス感染症(COVID-19)パンデミック期間中に拡大した臨床試験における分散型要素の実装
また、ポイントオブケア/実用的に関しては、以下のような特徴点を挙げている。
- 臨床研究の日常的医療への統合
- 既存の医療インフラストラクチャの利用(例:臨床評価を実施するための地域医療施設利用)
- 日常的医療の間に収集したデータの利用(例:リアルワールドデータ(RWD))
- 簡素化されたデータ収集による簡単なプロトコル
- 広い適格基準により、医薬品使用を意図する集団をより反映する可能性がある
- 臨床研究の日常的医療への統合を可能にする技術的進化(例:電子医療記録、相互運用性のあるデータシステム)による促進
その上で、分散型要素とポイントオブケア要素を組合せた手法について、以下のような方向性を例示している。
- オールオアナッシング型アプローチをとる必要はない
- 臨床試験をより効率的で包括的なものにするため、必要に応じて臨床試験に組み込むことが可能な要素またはツールを設計する
- 分散型要素とポイントオブケア要素の間のオーバーラップ
- 例.研究評価実施のための地域医療提供者利用
ここで図2(伝統的な臨床試験プロセスとGCP査察)と図3(分散型要素を備えた臨床試験のGCP査察)は、FDAの説明資料より、伝統的な臨床試験と分散型臨床試験におけるGCP査察の関係を示したものである。
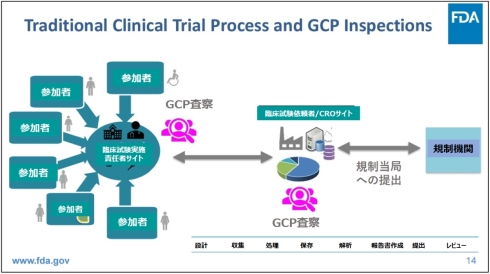
図2 伝統的な臨床試験プロセスとGCP査察[クリックで拡大] 出所: U.S. Food and Drug Administration (FDA)「Clinical Trials with Decentralized Elements and GCP Inspections - The US FDA's Perspective」(2024年2月13日)を基にヘルスケアクラウド研究会作成
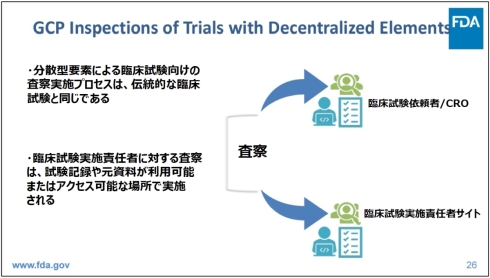
図3 分散型要素を備えた臨床試験のGCP査察[クリックで拡大] 出所: U.S. Food and Drug Administration (FDA)「Clinical Trials with Decentralized Elements and GCP Inspections - The US FDA's Perspective」(2024年2月13日)を基にヘルスケアクラウド研究会作成
FDAによると、従来型と比較して分散型臨床試験には、以下のような利点があるという。
- 臨床試験実施責任者サイトの周りに集中していない
- 参加者の移動をあまり必要としない
- 参加者にとってあまり時間を要しない
- 便利で費用が安い
- 臨床試験に参加するには遠い場所に住んでいる個人のアクセスを可能にする
- 臨床試験に登録する参加者の負荷を軽減する
FDAは、分散型臨床試験に対するGCP査察に関連して、臨床試験依頼者は、分散型要素に関連する記録や元資料が置かれ、アクセス可能な場所、そしてFDAの査察目的で臨床試験実施責任者およびその他の臨床試験要員に対するインタビューができるような場所を提供すべきだとしている。また、適用規制の下で、臨床試験監査に必要な情報に対して、FDAの査察官がアクセス可能なようにすべきだとしている。
参考までにFDAは、2023年5月1日、「医薬品、生物由来製品、機器向け分散型臨床試験 - 業界、臨床試験実施責任者およびその他のステークホルダー向けガイダンス草案」を公表している(関連情報)。
このガイダンス草案では、分散型臨床試験(DCT)について、試験関連の活動の一部または全てが、伝統的な臨床試験サイト以外の場所で行われるような臨床試験と定義している。DCTの場合、臨床試験関連の活動は、試験参加者の自宅や、試験参加者に便利な地域医療施設で行われる可能性がある。加えてハイブリッド型DCTの場合、伝統的な臨床試験サイトで試験参加者が対面診療を受ける一方、その他の活動については、患者の自宅など、臨床試験サイト以外の場で行われる可能性があるとしている。具体的には、以下のような構成になっている。
- I.イントロダクション
- II.背景
- III.DCTS実装の推奨事項
- A.DCT設計
- B.遠隔臨床試験訪問と臨床試験関連活動
- C.デジタルヘルス技術
- D.役割と責任
- 1.臨床試験依頼者
- 2.臨床試験実施責任者
- E.インフォームドコンセントと臨床試験審査委員会
- F.DCTにおける臨床試験製品
- 1.医薬品と生物由来製品
- 2.医療機器
- G.臨床試験製品の包装と出荷
- H.安全性モニタリング計画
- I.DCTの実施で利用されるソフトウェア
- 用語集
日本でも、分散型臨床試験に対する期待が高まっているが、デジタルのメリットを生かしたGCP査察業務の働き方改革まで踏み込んだ議論は、あまり見受けられない。AI医療機器のような新技術の導入に合わせて、従来の人海戦術と紙文書に依存した仕組みを変革することが求められている。
Copyright © ITmedia, Inc. All Rights Reserved.