加速するEU医療機器規則とIMDRFセキュリティ原則の国際調和:海外医療技術トレンド(69)(1/3 ページ)
本連載第50回で、欧州の医療機器規制改革とサイバーセキュリティ動向を取り上げたが、新規則施行に向けた動きが本格化してきた。
本連載第50回で、欧州の医療機器規制改革とサイバーセキュリティ動向を取り上げたが、新規則施行に向けた動きが本格化してきた。
欧州委員会が新規則移行時のレガシー機器向け指針を公表
「EUDAMED」は、欧州委員会が「医療機器規則(MDR)」(2021年5月26日適用開始予定)(関連情報)や「体外診断用医療機器規則(IVDR)」(2022年5月26日適用開始予定)(関連情報)を導入、展開するために開発しているITシステムであり、EU市場で利用可能な医療機器に関する情報の透明性と調整の向上を目指している(関連情報)。
EUDAMEDは、登録システム、協働システム、通知システム、普及システム(一般向け)として機能する多目的システムで、相互運用性が確保されたものであり、以下の6つの相互接続可能なモジュールと公開Webサイトから構成される。
- アクター登録
- 機器固有識別子(UDI)/機器登録
- 適合性評価機関と認証
- 臨床試験と性能試験
- ビジランスと市販後調査
- 市場監視
現時点でのEUDAMEDの導入状況は以下の通りである。
- EUDAMEDの構築・展開は、欧州委員会にとって優先順位が高い
- 欧州委員会は、医療機器調整グループ(MDCG)との合意書において、機能的である限り早く、徐々に異なるモジュールを利用可能にしていく
- アクター登録に関するモジュールは2020年12月以来利用可能になっている
- 機器固有識別子/機器登録に関するモジュール(第2モジュール)と、認証と適合性評価機関に関するモジュール(第3モジュール)は2021年9月までに利用可能になる予定で、残りのモジュールは機能的である限りできるだけ早く提示される予定
そして、2021年2月15日、欧州委員会は、「レガシー医療機器の管理第1.2版」(関連情報)と題するガイドラインを公表した。
欧州委員会は、この「レガシー機器」について、現行の医療機器指令、能動埋込型医療機器指令、体外診断用医療機器指令に準拠して発行された認証が適用される医療機器であり、医療機器規則や体外診断用医療機器規則の適用開始後も継続的に市場投入されるものと定義している。今回のガイドラインでは、レガシー機器がEUDAMEDにおいて識別される方法と、異なるレガシー機器向け機器固有識別子が生成され、割り当てられる方法について詳述している。
製造業者は、いかなるレガシー機器もEUDAMEDに登録することができる。ただし、重大なインシデントが発生した場合または市場安全是正措置が適用された場合には、少なくともフォローアップまたは最終ビジランス報告書が提出される前に、できるだけ速やかに登録することが求められる。
原則として、医療機器規則または体外診断用医療機器規則の適用開始日から18カ月以内に、レガシー機器をEUDAMEDに登録しなければ、EU域内で医療機器として販売を継続できなくなる。
また、現行指令に準拠した測定機能を有するリスク分類I該当のレガシー機器は、適合性評価機関が発行する認証を必要としないので、レガシー機器とは認識されない。この場合、新規則適用開始日から18カ月以内の間は、EUDAMED上の「規制機器」として登録する必要がある。
参考までに、図1は、医療機器向け機器固有識別子の管理プロセスを示したものである。
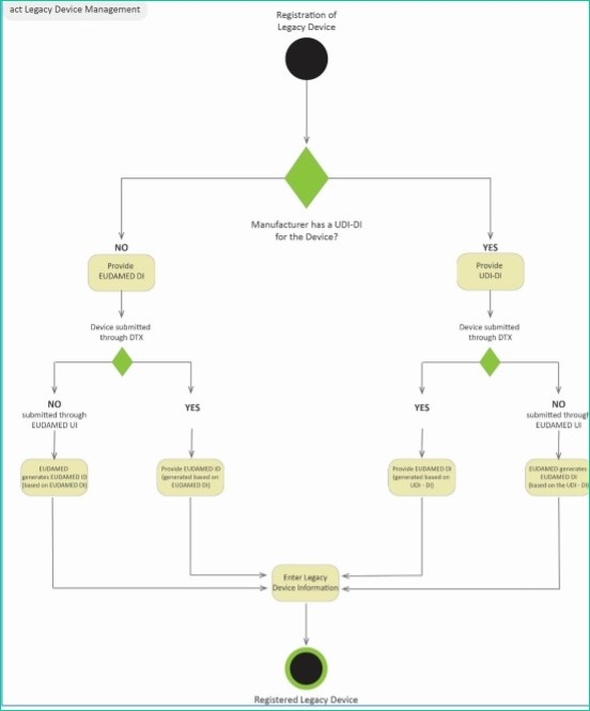
図1 医療機器向け機器固有識別子の管理プロセス 出典:European Commission「Management of Legacy Devices MDR EUDAMED Doc. Version: 1.2」(2021年2月15日)
Copyright © ITmedia, Inc. All Rights Reserved.